稳定的细胞内环境是细胞维持生物功能和进行生理活动的前提,细胞内环境物理参数,如细胞内压、细胞内部密度和弹性的测量可以为探索细胞生理活动的深层机制创造条件。当前的细胞内环境的研究主要集中在细胞内结构和化学成分的研究,而对细胞内环境参数的检测还相对较少。目前细胞的弹性、重量和细胞内压的测量需要原理不同的专门的仪器完成,因此无法使用同一设备对细胞的多个参数进行检测,进而分析各个参数对细胞生理活动综合影响。课题组利用显微操作机器人系统,进行细胞弹性、重量和内压三参数的自动化原位检测。具体的每个参数的检测介绍如下:

图1 传统细胞弹性(a-e)、重量(f-h)和内压(i-l)测量方法
批量自动化细胞弹性测量系统
通过与注射器相连的传输微管自动推动卵母细胞进入视野,通过图像检测对细胞粘连进行检测(图2a),进而使用测量针深入传输微针吸住细胞表面(图2b),传输针施加负压实现自动破粘连(图2c);进一步的测量微针离开传输针,自动吸持卵母细胞并测量细胞形变,最终获得细胞弹性数值(图2c)。整个机器人化细胞操作流程如图2所示:

图2 批量机器人化细胞弹性测量流程
基于细胞旋转检测的细胞重量测量方法
根据自动定位的细胞核注射针与吸持针位置。控制吸持针和注射针将细胞抬起并释放,在细胞下落过程中自动化聚焦细胞,根据光流法测量细胞的下落过程中的旋转程度,根据聚焦平面的实时位置获得选择不旋转的细胞的下落速度计算细胞重量。
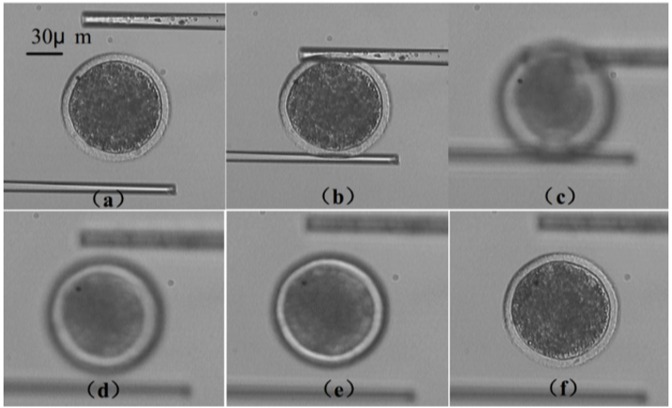
图3 机器人化细胞重量测量方法
基于改进平衡压模型的细胞内压测量方法
细胞内压是细胞内环境的重要组成部分,细胞内压的测量不仅有助于揭示细胞生理活动的机理,同时也能够提高细胞微操作的精度。目前对细胞内压的探索有些依赖专用的仪器,有些会影响细胞活性。课题组提出了一种基于改进平衡压模型的机器人化细胞内压测量方法,使细胞内压的测量步骤可被集成于传统细胞微操作的流程中。此方法利用注射微管刺入卵母细胞后微管口的液体来感知细胞气压。根据改进的平衡压模型,细胞内压对微管口液体施加的力可由气液交界面状态和细胞的形变计算出,如图4所示。根据此模型设计的机器人化流程在细胞刺入过程中实时检测气液交界面位置,夹角和细胞形变等参数,由此计算细胞内压,如图5和录像1所示。在猪卵母细胞上的内压测量实验表明该方法对平均每个细胞的操作速度为12秒,成功率为80%,操作后的细胞在后续的培养中有87.5%的成活率,证明此测量方法对细胞的伤害有限。上述工作已经发表在IEEE Transactions on Instrumentation and Measurement杂志上(Qiu Jinyu, Zhao Qili*. IEEE-TIM, Vol.73, No. 4003209, 2024)。

图4 改进平衡压模型示意图

图5 细胞形变实时检测
录像1 气液交界面状态实时检测
基于微量移液管电极的机器人细胞内压测量方法
课题组使用传统的微量移液管电极系统(图6),对所测量的微量移液器在培养基内的电阻进行建模,分析当微量移液器内的压力增加时其变化趋势。然后,根据测试的电极电阻-压力关系确定适合细胞内压力测量的微量移液器电极内填充的KCl溶液的浓度。此外,对细胞内的微量移液管电极的测量电阻进行建模,以通过释放细胞内压力前后的内压差来测量细胞内压力,并建立了基于传统微吸管电极系统的细胞内压力机器人测量程序,如图7和图8所示。对猪卵母细胞的实验结果表明,该方法的平均操作速度为20-40 cells/day,测量效率与相关工作相当。测量的电极电阻与微管电极内部压力之间的平均重复误差小于5%,并且在测量过程中没有发现可观察到的细胞内压力泄漏,这两者都保证了细胞内压力的测量准确性。猪卵母细胞的测定结果与文献报道的结果一致。此外,测量后获得了90%的手术卵母细胞存活率,证明对细胞活力的损伤有限。该工作已经发表在Sensors杂志上(Li Minghui, Zhao Qili*. Sensors, 23(10): 4973, 2023)。

图6 微管电极制作 (a)电极夹持器 (b)玻璃管拉拔成直径约为2μm的锥形尖端 (c)微管尖端弯曲30 °

图7 细胞内微管电极的电阻分布 (a)刺入细胞的测量微管电极电路 (b)刺入细胞的微管电极中的离子浓度分布

图8 细胞内压力测量结果 (a)微管电极在释放细胞内压力前穿透细胞 (b)微管电极在释放细胞内压力后穿透细胞 (c)~(d)第一准稳态下的电阻值和相应的压力 (e)~(f)第二准稳态下的电阻值和相应的压力
基于气压变化模型的机器人化无视觉细胞转运方法
细胞转运是许多生物应用中的关键步骤。目前,大多数细胞转运研究都依赖于显微视觉反馈,这限制了其在无法获得显微视觉的地方的应用。课题组首次提出一种基于气压变化模型的机器人无视觉细胞转运方法。制作了一种双层微吸管,通过将一个薄的微吸管套入一个厚的微吸管中制成,如图9所示。在细胞转运过程中,外层微管拾取靶细胞,内层微吸管固定靶细胞。为实现这一点,基于力分析来确定拾取和放置细胞的适当流体力。然后,基于微吸管抽吸模型确定了合适的内细微吸管内径。此外,建立了双层微移液器在保持和释放过程中内部压力变化的模型,并进行了机器人显微视觉验证,如图10所示。实验结果表明,该系统能够以平均每个细胞25s的速度转运斑马鱼胚胎,转运成功率为90%,转运效率与显微视觉反馈的相关方法相当。此外,通过培养实验证实了机械损伤对斑马鱼胚胎发育能力的影响可忽略不计。上述工作已经发表在IEEE Transactions on Automation Science and Engineering (Qiu Jinyu#, Zhu Ripeng#, Zhao Qili*. IEEE-TASE, 22: 4134-4144, 2025)。

图9 双层微量移液器的显微图像及宏观图像

图10 无视觉反馈的的细胞转运过程。(a)-(c)显微镜下的细胞吸持和释放过程。(d)吸持过程中双层微管内的压力变化。(e)每隔三个压力采样间隔计算一次的细胞吸持过程中的压力变化速度。(f)在释放细胞的过程中,双层微吸管中的压力变化。(g)每隔三个压力采样间隔计算释放细胞过程中的压力变化速度。
基于微管电阻模型的机器人化细胞转运系统
细胞转运技术是众多细胞工程应用中的关键步骤。然而,当前大多数细胞转运操作依赖显微镜视觉引导,这并不适用于未来集成化、自动化的无法获取显微视野的细胞工程应用场景。现有无显微视觉的细胞转运系统因微量移液管的双层结构限制,仅适用于特殊巨型细胞。课题组基于微管阻力模型开发了机器人细胞转运系统,可在无显微视野条件下运输常规尺寸细胞。首先制备了窄颈微管,用于在运输过程中将目标细胞固定于微管内,如图11所示。随后分别开发了间隙电阻模型、吸持电阻模型和注射电阻模型,使微管能够在无显微镜观察的情况下精准降落于细胞平面、吸持并释放细胞。基于上述工作,建立了一套无需显微镜观察即可运输常规尺寸细胞的机器人运输流程。最终实验结果表明,该系统可实现100%成功率的细胞平面触底,能高效转运10微米级HeLa细胞及100微米级猪卵母细胞,如图12所示,机器人化运输过程如录像2所示。其效率可媲美常规显微镜观察法,且不损害细胞存活率。未来本显微细胞运输系统可升级为高通量版本,用于集成自动化细胞工程应用。上述工作已被SCI一区顶刊Microsystems & Nanoengineering录用(Zhao Qili, Liumengya, Zhao xin*)。
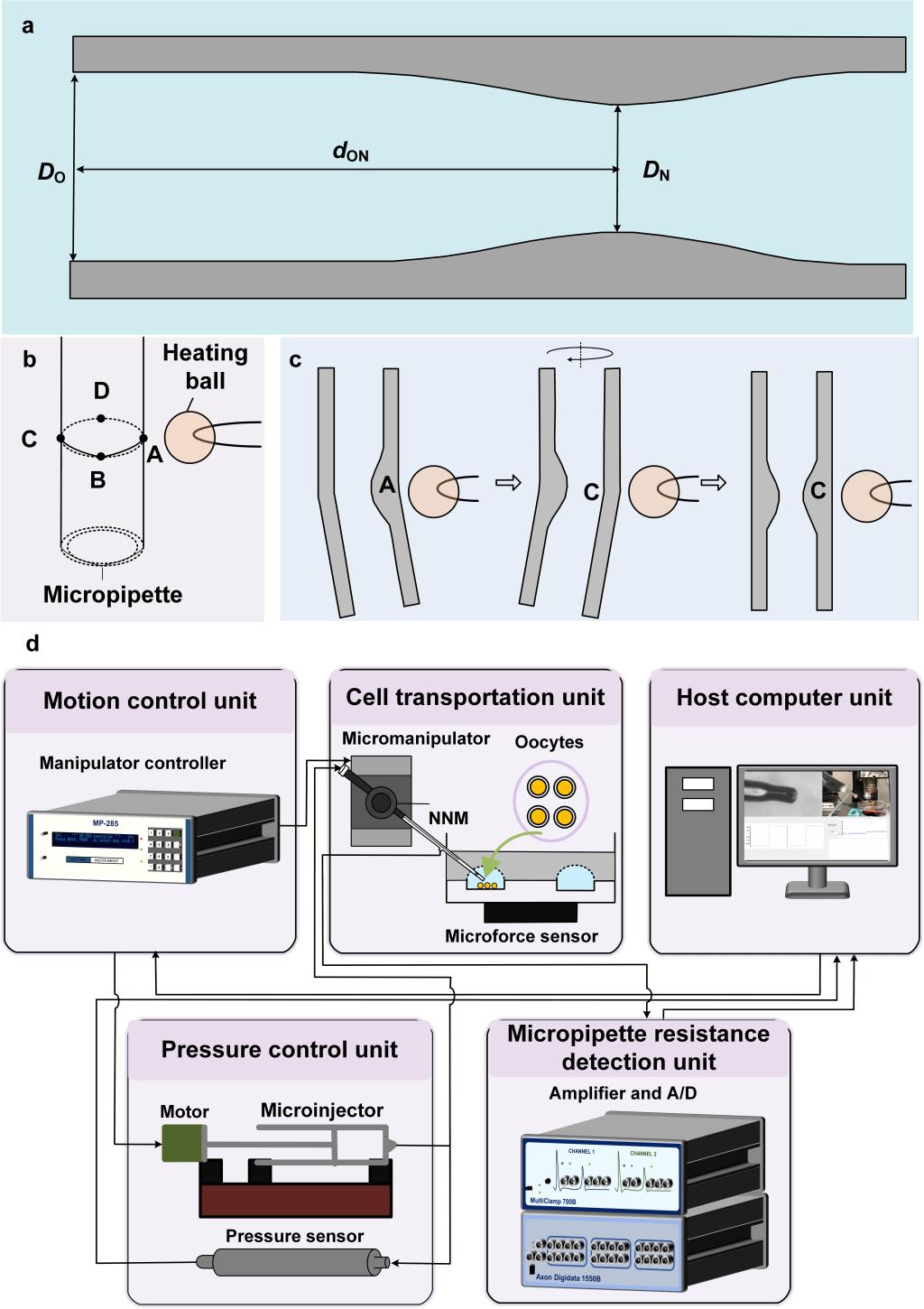
图11 窄颈微管的制造过程和机器人化转运系统的系统设置。(a)窄颈微管的三项关键几何参数:微管开口处的内半径DO、窄颈位置处的内半径DN以及开口与窄颈位置间的距离dON。(b)用于将普通直型微管改制为窄颈微管的加热装置及四个加热点。(c)通过加热旋转工艺制造窄颈微管的操作流程。(d)机器人化细胞转运系统中的硬件设备与通信流程。
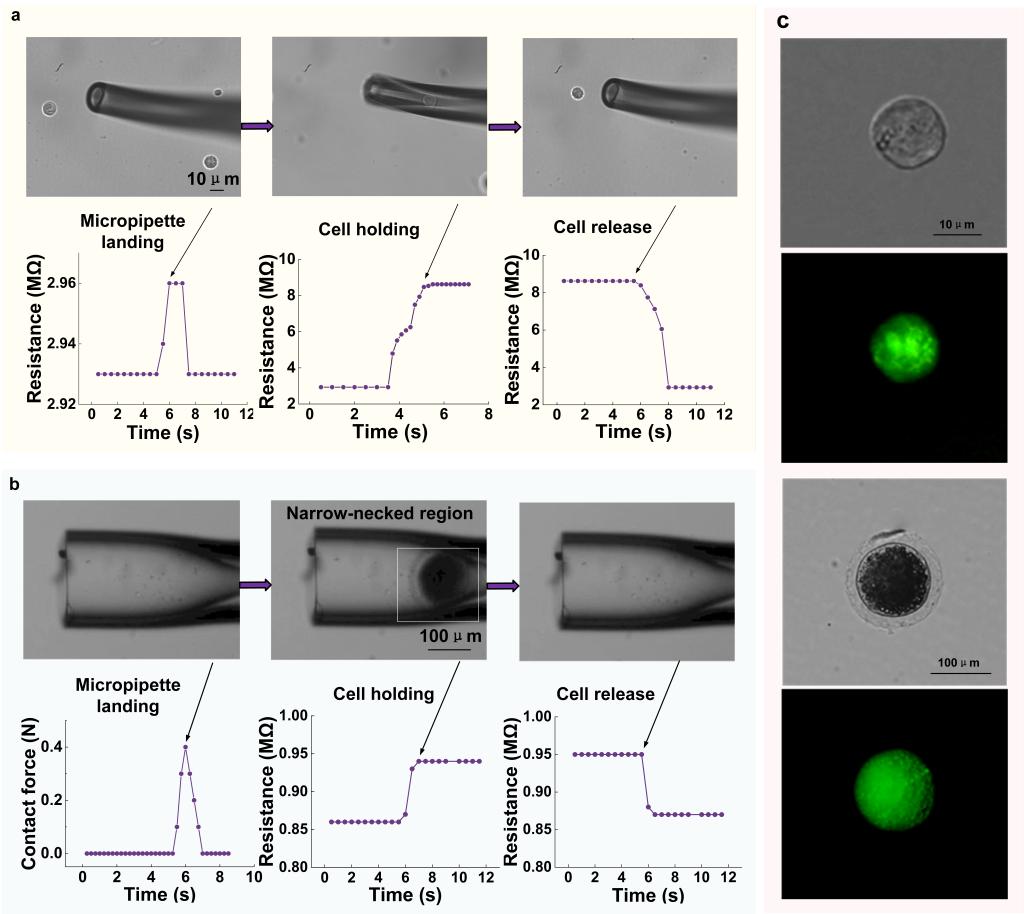
图12 HeLa细胞与猪卵母细胞的机器人运输结果及细胞存活率检测结果。(a)微管触底、HeLa细胞吸持与释放的显微图像,以及这三个过程对应的阻力曲线。(b)微管着陆、卵母细胞吸持与释放的显微图像,以及这三个过程对应的阻力曲线。(c)转运后培养24小时的HeLa细胞与卵母细胞明场图像,以及FDA染色的对应荧光场图像。
录像2 机器人化Hela细胞和猪卵母细胞的转运过程
用于精确测量细胞机械特性的机器人化改进型微量吸持法
细胞的力学特性对细胞的功能、组成、生理和病理起着重要的调节作用。目前测量细胞弹性的方法多依赖专用的仪器,微管吸持法因其具有更少的设备需求,更大的吸持压范围而被广泛用于测量细胞的弹性。然而,目前的微管吸持技术研究通常将目标细胞视为一个简单的空心或实心球体,其表面光滑,所用吸持微管的大小通常由经验决定。细胞内压力、细胞与微量移液管之间的摩擦力、微量移液管开口尺寸等因素对细胞弹性测量结果有明显影响的因素往往未考虑到,从而导致显著的测量误差。为此课题组提出了一种考虑上述三个因素影响的改进型机器人微管吸持法,用于提升细胞力学特性测量精度。具体说来,该方法通过自动释放细胞内压力(图13)、抛光微量移液管开口(图14)和控制微量移液管的内径(图15)来减少细胞弹性测量误差,提高细胞弹性的测量精度,整个过程如录像3所示。通过有限元仿真和微管吸持实验验证了提出方法的有效性,猪卵母细胞的实验结果表明,课题组提出的方法可纠正由上述三个因素引起的分别为20.11%、35.08%和6.80%的细胞杨氏模量测量误差。上述工作已经发表在IEEE Transactions on Instrumentation and Measurement杂志上(Liu Mengya, Zhao Qili*. IEEE-TIM, 74: 1-8, 2025)。
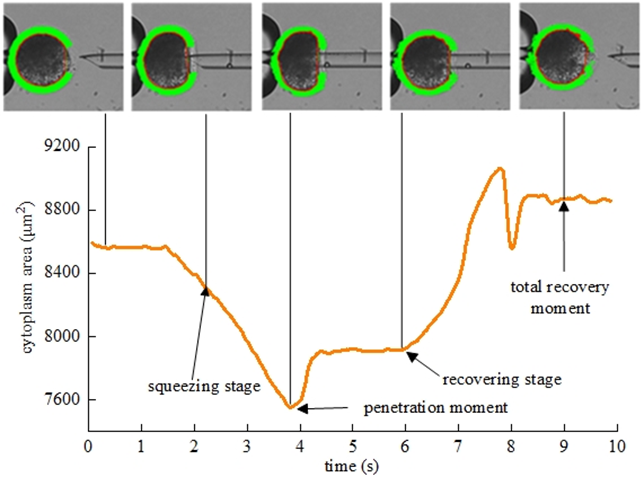
图13 自动释放细胞内压力检测
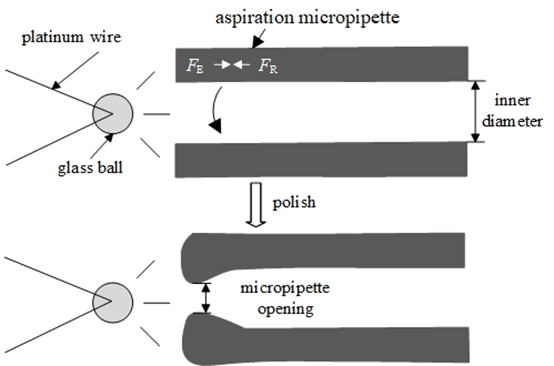
图14 微管开口抛光过程的受力分析
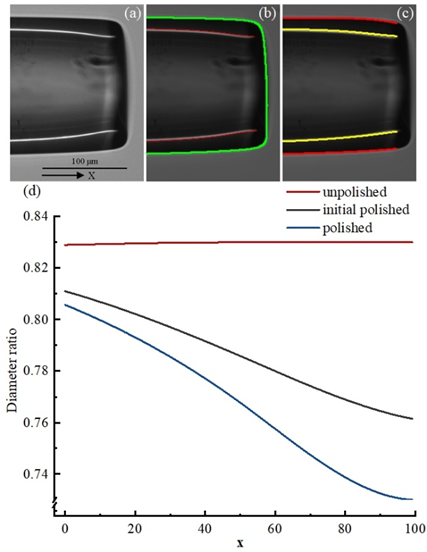
图15 基于图像处理的抛光检测结果(a)外表面检测结果(b)内表面检测结果(c)拟合的外表面和内表面(d)沿X轴获得的直径比
录像3 机器人化改进型微管吸持过程

