自从“多莉”羊诞生之后,细胞核移植(克隆)技术因其在动物育种、器官移植、基因治疗和濒危物种保护等领域的巨大应用价值,已成为21世纪各国的研究热点。然而,目前手动核移植操作的细胞转动和去核过程对卵母细胞的伤害极大,大大降低了克隆胚胎的发育潜力,造成了目前核移植操作极低的成功率。项目组进行了最小拨动力的细胞转动,基于细胞形变建模的细胞朝向选择和无染色的细胞精准去核操作三个方面入手,建立了机器人化的核移植操作流程,提高操作效率的同时减小了核移植操作对卵母细胞的伤害,最终显著提升了克隆胚胎的发育能力,获得了世界首例机器人操作的克隆动物。
基于最小拨动力的定量细胞转动方法
首先对细胞拨动过程进行静力学建模,通过对拨动中的卵母细胞进行受力分析,获得了可以克服摩擦阻力,精准转动细胞所需的最小拨动力。根据测得的细胞弹性,获得了施加最小拨动力的注射针运动轨迹,最终实现了细胞的精准定量拨动,将细胞拨动误差降低到1.2°,形变减少到原来的30%左右。上述工作已经发表在IEEE Transactions on Automation Science and Engineering (Qili Zhao, Xin Zhao*,IEEE TASE,Vol.12, No.4, pp.1504-1515, 2015)。
图1 细胞拨动过程的受力分析和获得的细胞拨动轨迹
基于细胞受力形变建模的卵母细胞朝向研究
首先利用测得卵母细胞透明带和胞质的弹性对刺入过程中的细胞变形进行有限元仿真,获得不同点位处细胞应变,从中找出细胞形变较小的点位(2点和4点钟),进而通过光流法对刺入过程中的细胞形变进行检测,验证此点位处细胞的应变确实较小,进一步的,将极体置于该点位,最终获得了核移植中的卵母细胞的对应的细胞朝向范围,如图2所示。
图2 基于细胞受力形变建模的卵母细胞朝向研究
基于动态漂移建模精准极体拾取方法研究
首先,提出一种离焦成像法,以定位外观近乎透明的极体,如图3所示。其次,基于受力分析,对微量移液器在细胞内移动时极体的动态漂移进行在线建模,从而确定微量移液器接近极体的最优轨迹,如图4所示。此外,引入了自抗扰控制器(ADRC),驱动微量移液器沿预定轨迹靠近极体,并将其吸入移液器内,控制流程如图5所示。验结果表明,该系统对极体的定位成功率达 95%,平均误差为 1.12±0.14 微米。沿确定轨迹移动时,微量移液器能够以 1.84±0.31 微米的平均误差(n=20)接近极体边缘,这一误差仅为未进行极体动态漂移估计时的 11%。得益于这一优势,与未采用动态漂移估计的操作结果相比,该系统的极体拾取成功率提升近 60%(95% vs 60%),平均细胞质流失量仅为原来的一半(5% vs 10%)。上述工作发表在IEEE Transactions on Automation Science and Engineering (Ruimin Li, Minghui Li, Qili Zhao*, IEEE TASE,Vol.22,pp:5895-5905, 2024)。
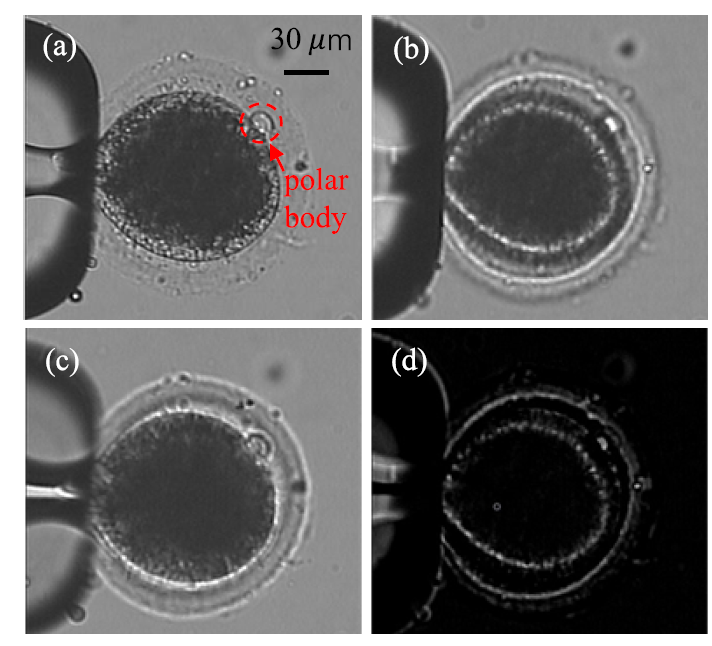
图3 极体定位的离焦成像法。(a)含极体的卵母细胞处于聚焦状态;(b)含极体的卵母细胞处于正离焦状态;(c)含极体的卵母细胞处于负离焦状态;(d)正离焦图像与负离焦图像的差值图像。
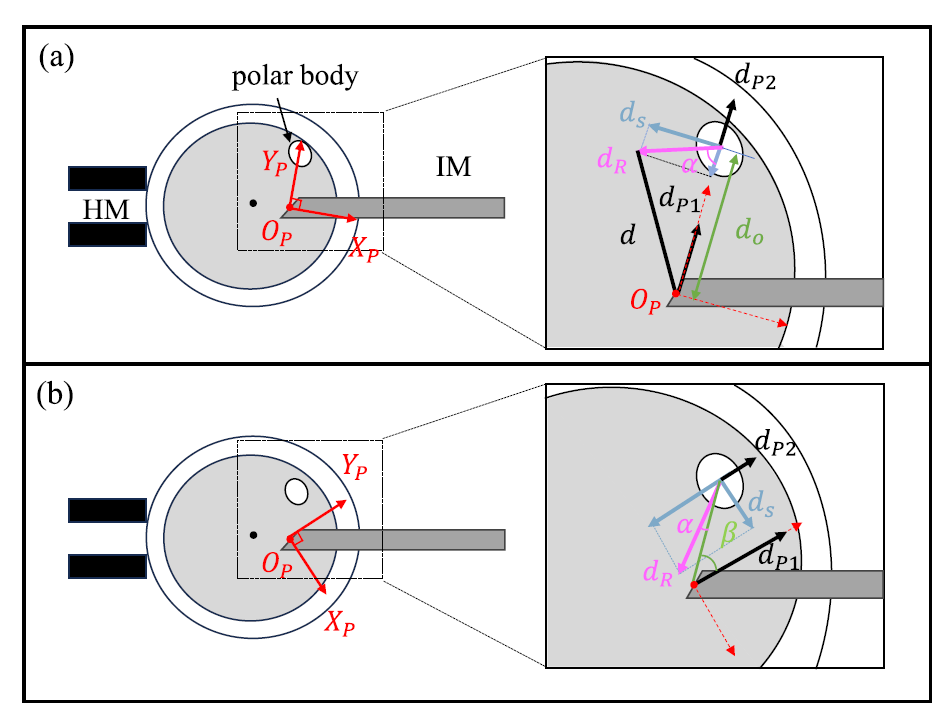
图4 微量移液器(IM)靠近极体时的极体受力分析示意图。(a)微量移液器开口中心朝向极体中心移动,极体与移液器呈 α 角远离时的极体受力分析示意图;(b)微量移液器开口以 β 角朝向极体移动,极体与移液器开口中心呈 α 角远离时的极体受力分析示意图。
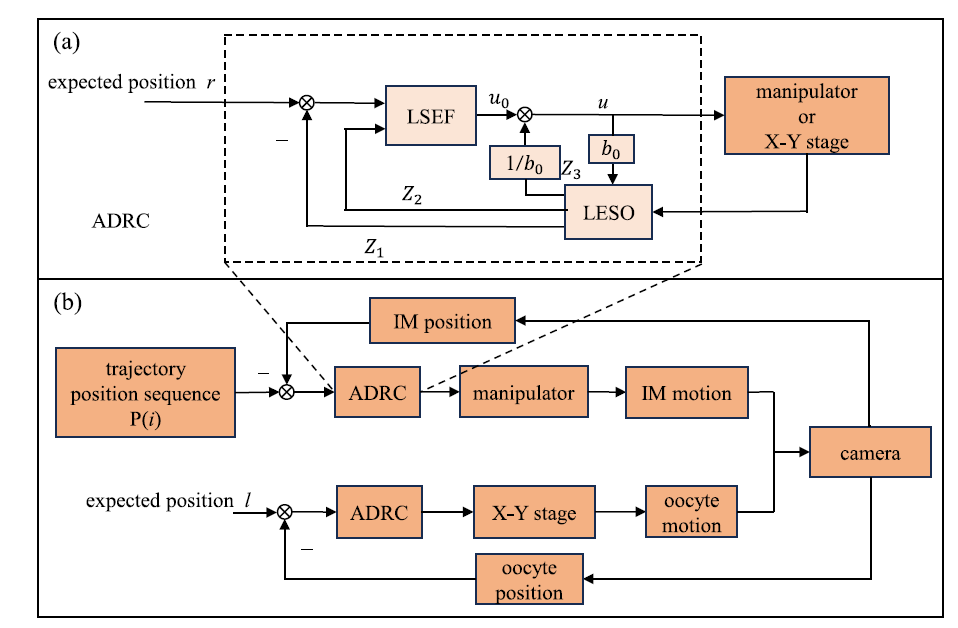
图5 机器人极体提取的完整工作流程。(a)自抗扰控制器(ADRC)框图;(b)机器人极体拾取的实现分为两个控制阶段:(1)通过自抗扰控制器控制电动位移台(图下半部分),将极体定位至显微镜视野的指定位置 l;(2)通过自抗扰控制器控制机械臂跟踪期望轨迹 P (i)(图上半部分),实现微量移液器(IM)的运动控制。
机器人化无染色细胞精准去核方法研究
首先,通过对去核抽取过程进行有限元建模,获得以去除细胞核所需要的吸取胞质体积分布如图6所示;之后通过离线的细胞核染色最终获得了细胞核相对极体的三维分布,并由前两步工作确定适合精准去核的细胞朝向,如图7所示;再进一步,利用有限元仿真确定细胞核相对于注射针的运动轨迹,并基于前面的两个分布确定将细胞核移动到注射针的特定位置所需要的注射针运动轨迹,如图8所示;在此基础上,通过去核量的计算完成细胞的定量去核,实现以5%的胞质去除量达到手动操作20%的胞质去除量的去核成功率(90%),将细胞的卵裂率提升30%,如图9所示。上述工作发表在IEEE Transactions on Biomedical Engineering (Qili Zhao, Xin Zhao*, IEEE TBME,Vol.68, No.8, pp:2348-2359, 2021)。
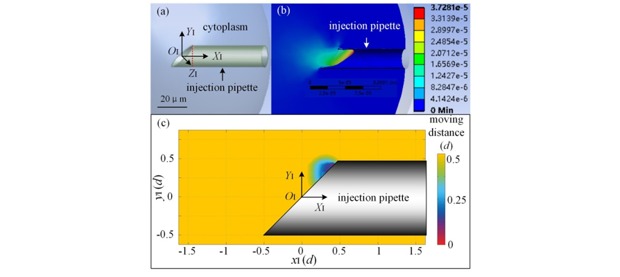
图6 胞质抽取过程建模(a)有限元模型(b)抽取过程胞质的移动距离(c)去核所需抽取胞量分布
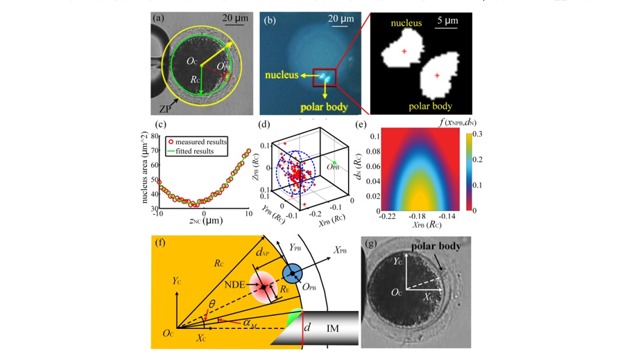
图7 基于细胞核三维分布的细胞朝向选取(a)细胞极体定位结果(b)细胞核与极体定位(c)细胞核聚焦结果(d)细胞核相对极体的三维位置分布结果(e)拟合确定的细胞核相对极体的分布(f)适合精准去核的卵母细胞定位(g)实际核移植操作的极体点位
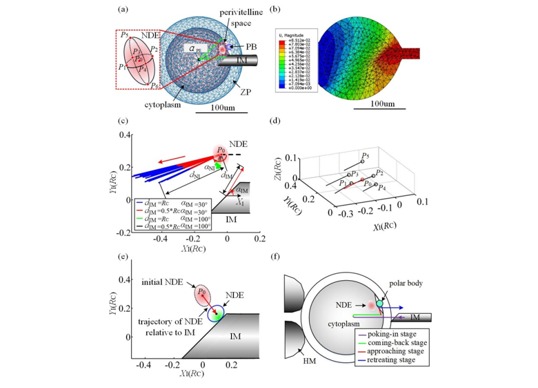
图8 精准去核的注射针运动轨迹获取(a)微针在细胞内运动有限元仿真(b)有限元仿真结果(c)细胞核相对微针运动轨迹(d)不同分布点处细胞核运动轨迹(e)细胞核分布区域移动轨迹(f)注射针在细胞核内的运动轨迹

图9 定量去核(a)细胞拨动之后的图像(b)注射针刺入细胞(c)细胞质定量抽取(d)去核后的卵母细胞
自动化批量细胞核移植操作流程
针对手动核移植操作中存在的细胞分布区域过大,搜寻细胞耗时较长,效率较低的缺点。项目组利用构建的微通道和双持针器实现了结构化的高效自动化核移植操作流程,进一步提高了体细胞核移植的操作效率。如图10所示。
图10 改进的批量自动化核移植操作流程(a)(b)传统的人工细胞核移植操作流程(c)(d)结构化自动化批量核移植操作流程
家猪自动化批量细胞核移植操作流程
实验表明基于以上关键技术,课题组将体细胞核移植的囊胚发育率从人工的10%提升至20%,获得活体的成功率从1%提升至3%,2017年项目组获得了世界首批机器人操作的克隆猪,研究成果收到了央视和人民网等多家国内外权威媒体的报道。如图11所示。

图11 世界首批机器人操作的克隆猪

