脑科学是寻求人或动物神智活动的细胞及分子层次生物机制的科学。膜片钳操作通过使用微米级的电极微管吸附脑神经细胞表面,将平方微米级的细胞膜吸入微管,使其与管壁形成G欧姆级的高电阻封接(高阻封接),对环境电磁噪声进行有效屏蔽,从而对膜片上离子通道的开关产生的皮安级(10^-12A)电流进行检测,被誉为脑科学离子通道研究的“金标准”。人工膜片钳操作因操作难度大,操作成功率低,严重限制了脑科学的发展。开发机器人化膜片钳系统取代人工操作已成为推进脑科学发展的当务之急。近年来脑科学研究的对象经历了从贴壁细胞、到小鼠脑片组织、再到活体老鼠和非人灵长类动物的发展历程。相应地,机器人化膜片钳系统也经历了从基于微管电极手动膜片钳系统,平面膜片钳系统、传统膜片钳系统、盲法膜片钳系统和双光子膜片钳系统的发展过程,如图1所示。该部分工作的总结已经发表在《机器人》杂志上(赵启立等,《机器人》,2022, 44(6): 720-731)。

图1 机器人化膜片钳系统发展历程(赵启立等,《机器人》,2022, 44(6): 720-731)
清醒非人灵长类动物脑科学研究是当前的脑科学研究的前沿领域。课题组将显微操作机器人与双光子显微镜相结合,进行了面向清醒动物脑科学研究的主动机器人化膜片钳系统的研究。针对当前双光子活体膜片钳操作系统存在的操作“盲”,定位“缺”,动作“拙”,实验“难”和动物运动“跟不上”的问题(如图2所示),课题组将在未来五年内突破五大挑战,研制具有“显示清”、“定位准”、“动得巧”、“测得真”、“跟得上”五大功能的机器人化主动膜片钳系统,如图3所示。
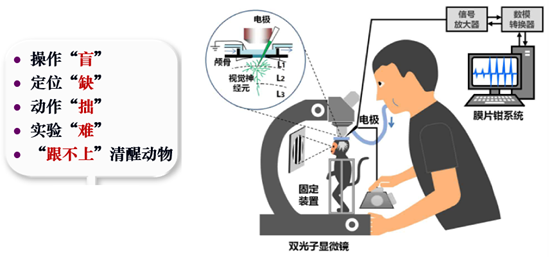
图2 当前清醒活体动物膜片钳操作的挑战

图3 面向清醒的机器人化主动动物膜片钳系统示意图
具体研究内容包括:研制1个系统,面向清醒动物脑科学研究的机器人化主动膜片钳系统;突破5项关键技术,清醒动物主动固定与跟踪、基于膜片钳电极内荧光染料流速控制的动态荧光成像、基于双光子显微图像的三维重建与精准定位、机器人化膜片钳系统的运动规划与主动避障、机器人化细胞封接、破膜与精准检测;最后,集成关键技术与系统,实现清醒狨猴大脑视觉皮层感应神经元电生理特征研究的突破性示范应用,来验证本项目功能优越性,同时利用阿尔茨海默病模型小鼠皮层神经元电生理特征研究拓展本项目在不同动物方面的广泛适用性。研究内容如图4所示。
图4 面向清醒动物脑科学研究的机器人化主动膜片钳系统研究内容
随着膜片钳技术的发展逐渐衍生出贴附式、全细胞式、穿孔式内面朝外式、外面朝外式五种基本模式。课题组在贴壁细胞和脑片神经细胞对上述五种模式的自动化操作进行大量研究,每种模式的工作原理及其相互转化关系与具体成果介绍如图5所示。

图5 当前膜片钳的5种基本记录模式
1.基于气压-电压双驱动的精准高阻封接方法研究
膜片钳技术能够测量皮安级别的离子通道电流,这得益于细胞膜与玻璃壁能够形成紧密封接隔绝外部环境的噪声,使流过电极的电流主要来源于离子通道。这种紧密贴附结构的电阻能够达到吉欧以上,被称为“高阻封接”,是影响膜片钳记录成功率和信噪比的关键,如图6所示。然而,当前的膜片钳操作主要利用手动施加吸持气压来形成高阻封接,难以保证高阻封接的成功率和封接质量,限制了膜片钳技术的效率和广泛应用。课题组提出了一种气压与电压共同驱动的膜片钳高阻封接方法。首先,气压和电压在封接过程中对膜片施加的力被分别建模,并基于此建立了封接过程中膜片的动力学模型,如图6所示。根据动力学模型,一个双输入的自适应滑模控制器被设计用来控制封接过程中封接电阻的轨迹。脑片神经元的膜片钳实验表明,该方法相比于手动封接和PID控制器有更高的成功率和更高的封接阻值,更高质量的封接也提高了该方法的稳定记录时长,如图7和图8所示。上述工作已经发表在IEEE Transactions on Instrumentation and Measurement杂志接收(Jinyu Qiu, Qili Zhao*. IEEE TIM)。

图6 气压电压双驱动高阻封接动力学模型

图7 高阻封接方法与手动操作和PID控制器的对比实验结果

图8 操作后的脑片神经元动作电位和EPSCs信号记录
2.基于无接触细胞三维形态检测的精准全细胞膜片钳技术
为了便于高阻封接的形成,需要在封接操作前在细胞表面上选择合适的接触点,使微管与细胞表面对准,使其与细胞表面尽量垂直,增加二者的接触角,便于施加负压后使得细胞表面覆盖微管口从而利于高阻封接的形成。选择合适的接触点需要事先获得细胞的三维形态,又因为微管接触细胞表面容易导致微管堵塞,因此需要对细胞的三维形态进行无接触的检测。为此,课题组首先建立了入液电阻模型,基于该模型对细胞的三维形态进行精准检测如图9和10所示。基于细胞三维形态选取接触角最大的点进行高阻封接和破膜,如录像1和录像2所示,最终显著提升了细胞的高阻封接和全细胞膜片钳操作成功率。上述工作已经发表在IEEE Transactions on Instrumentation and Measurement杂志上(Qili Zhao, Jinyu Qiu,*Xin Zhao et.al, IEEE TIM Vol.71, No. 9508812, 2022)。

图9 微管电极入液电阻模型
录像1 无接触细胞三维形态检测过程录像
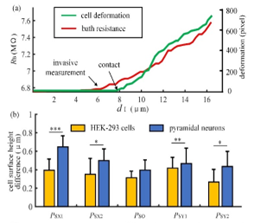

图10 无接触细胞三维形态测量结果
录像2 机器人化全细胞膜片钳操作过程录像


图11 全细胞膜片钳实验结果
3.基于穿孔物质主动释放控制的精准穿孔膜片钳技术
为了提高破膜的效率,课题组提出使用化学物质穿孔破膜的方式代替传统气压破膜,提出了一种基于穿孔物质主动释放控制的机器人穿孔膜片钳方法。目前穿孔物质的释放仍采用被动方案,穿孔过程时间较长,且穿孔物质在微管口的聚集会对高阻封接产生不利影响,这大大降低了穿孔膜片钳实验的效率。针对这一问题,实验室开发了一套基于穿孔物质主动释放控制的机器人穿孔膜片钳系统。首先,设计开发了一种新型侧面深入式三通道微管夹持器,该模块集成了独立驱动的穿孔物质传输通道,如图12所示。然后,通过穿孔物质释放试验,确定了响应速度更快、稳定性更高的液压驱动模式。根据菲克定律对孔道开口处穿孔物质的浓度梯度场进行建模,防止穿孔物质在高阻封接形成过程中误释放。此外,建立了在线检测穿孔程度的细胞穿孔电路模型,通过阶跃输入下跨膜电流峰值对穿孔程度进行反馈,从而物质释放进行闭环反馈控制,如图13和录像3所示。小鼠脑切片锥体神经元的实验结果表明,与传统的被动释放穿孔物质的方法相比,该系统能够以几乎两倍的吞吐量穿孔细胞膜,成功率提高57%。与传统的无孔全细胞膜片钳法相比,由于对高阻封接的负面影响较小,几乎没有细胞内容物损失,我们的方法操作的神经元的信号记录时间增加了一倍,如图14所示。上述工作已经发表在IEEE Transactions on Automation Science and Engineering杂志上(Chaoyu Cui, Qili Zhao*, IEEE TASE, 14(8): 5170-5181, 2024)。

图12 侧面深入式三通道微型夹持器

图13 细胞穿孔电路模型
录像3 基于跨膜电流峰值的闭环穿孔破膜过程录像

图14 穿孔膜片钳实验流程。(a)微针定位。(b)神经细胞定位。(c) 高祖封接形成。(d)释放穿孔材料后5分钟的跨膜电流峰值。(e)跨膜电流峰值随时间的变化曲线。
4.基于囊泡破裂控制的机器人化内面朝外膜片钳系统
在单通道膜片钳技术中,课题组进行了内面朝外模式膜片钳技术的研究,提出了一种针对贴壁细胞的基于囊泡破裂控制的机器人内面朝外膜片钳方法。课题组首次提出了一种针对贴壁细胞的基于囊泡破裂控制的机器人内面朝外膜片钳系统,如图15所示。首先,课题组建立了基于跨膜电流响应的阻抗模型,用于检测囊泡破裂状态,如图16所示。随后,基于离焦成像模型对囊泡出入液的时间进行检测,并基于出入液时刻对微管的液外运动轨迹进行设计,从而精确控制囊泡在空气中的暴露时间,如录像4和图17所示。实验表明,暴露时间对囊泡破裂有显著影响。在此基础上,基于囊泡破裂控制建立了针对贴壁细胞的机器人内面朝外膜片钳操作流程如录像5所示。实验结果表明,课题组提出的机器人内面朝外膜片钳系统能够以100%的成功率检测囊泡破裂状态,暴露时间控制误差平均为0.02秒,操作HEK-293细胞的成功率为70%,平均操作速度为61.3秒/细胞。相比手动操作,成功率具有显著优势,为后续单离子通道功能研究奠定了坚实基础。上述工作已经在线发表在IEEE Robotic Automation Letters杂志上(Liu Yuzhu, Zhao Qili*. IEEE RAL, 10(3): 3014-3021, 2024)。

图15 基于囊泡破裂控制的机器人内面朝外膜片钳系统

图16 囊泡电路模型示意图
录像4 基于离焦成像模型的微管出入液检测过程

图17 微管在液体外暴露过程轨迹规划示意图
录像5 机器人化内面朝外膜片钳过程
5.基于交互力学建模的机器人化双电极膜片钳系统用于神经元之间的功能连接测量
课题组提出了一种基于交互力学建模的机器人化双电极膜片钳系统,用于研究脑片中神经元之间的功能连接。首先,建立了双微管电极在粘弹性脑组织环境中分别接近目标细胞的交互力学模型,用于估计细胞的动态漂移。基于该模型,设计了微管同步下降策略、细胞对之间的相对位置以及双微管的在线轨迹规划,以减小细胞的动态漂移,如图1所示。最后,结合上述方法提出了一种机器人化双电极膜片钳操作流程,用于脑切片中神经元对之间功能连接测量,如图2和录像1所示。课题组在小鼠脑片初级视皮层的60个锥体神经元上进行实验。结果表明,与传统人工方法相比,本方法在成功率上提升了40%,在操作速度上提升了 38%。利用这些优势,实验中通过不同电刺激协议同时获得了突触前和突触后之间的多种电生理信号,包括突触前细胞的动作电位(APs)引发突触后细胞的兴奋性突触后电位(EPSPs)和突触前细胞的离子通道电流引发突触后细胞的兴奋性突触后电流(EPSCs),如图3和录像2所示。系统显著提高了脑切片中神经元之间的功能连接测量效率,因此该方法在未来有可能应用于神经疾病模型中突触连接异常的定量评估和新型药物或神经调控手段对神经环路功能影响的验证。上述工作已经被IEEE Transactions on Automation Science and Engineering杂志接收(Biting Ma, Qili Zhao*. IEEE TASE)。
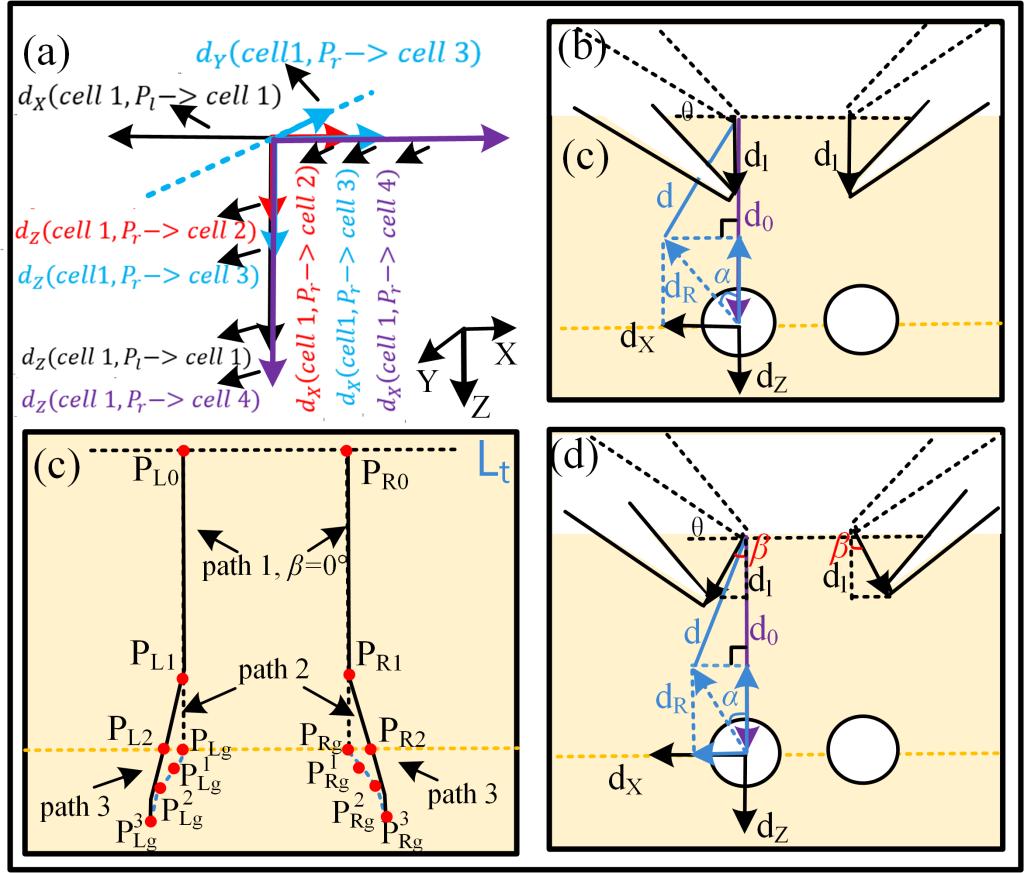
图18 目标细胞漂移分析与微管电极轨迹设计。(a)在选择不同目标细胞对时,细胞的漂移方向与幅值。(b)微管电极沿 Z 轴下降时目标细胞漂移分析的示意图。(c)微管电极的轨迹设计。(d)微管电极以 β 角度下降时目标细胞漂移分析的示意图。
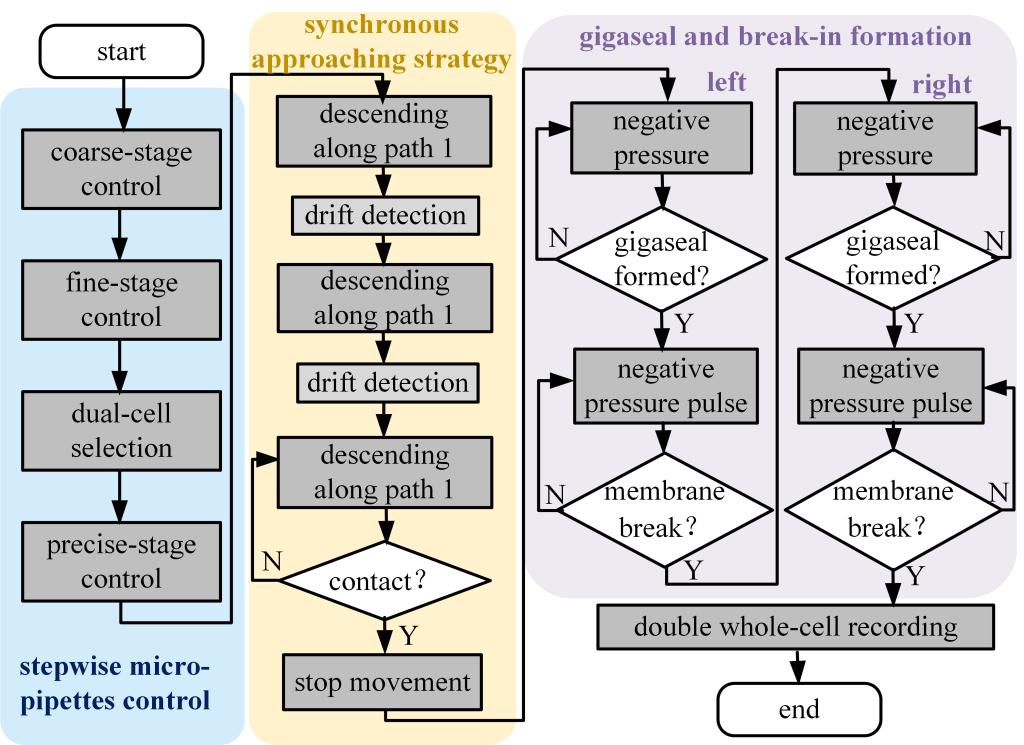
图19 机器人化双电极膜片钳操作流程示意图
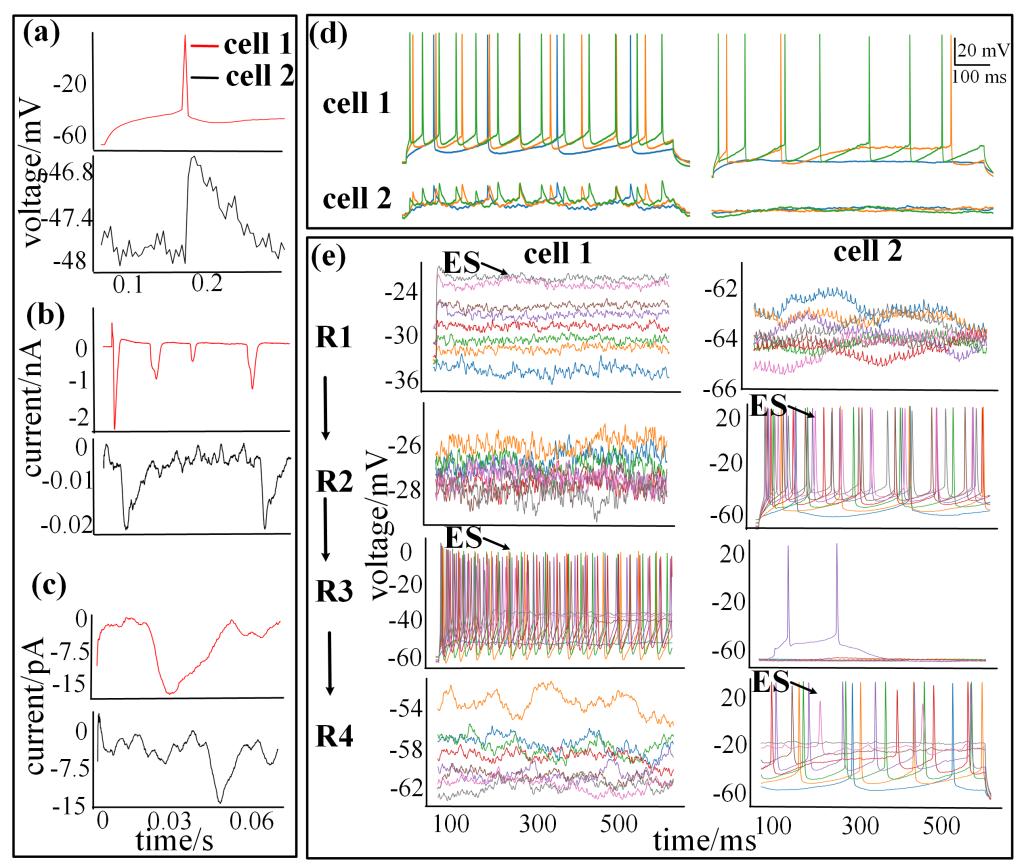
图20 双电极全细胞记录的电生理信号。(a)细胞 1 在施加 100 pA 电流刺激下产生的动作电位(APs),触发细胞 2 中的兴奋性突触后电位(EPSPs)。(b) 在膜电位钳制于 40 mV 时,细胞 1 的离子通道电流,并在细胞 2 中产生的兴奋性突触后电流(EPSCs)。(c) 在膜电位钳制于 -70 mV 时,细胞 1 和细胞 2 产生的 EPSCs。(d) 在对细胞 1 施加从 -80 pA 到 200 pA、步长为 20 pA 的电流注入时,细胞 1 和细胞 2 的电压记录轨迹,左图为存在功能连接现象,右图为不存在功能连接现象。 (e) 在分别对细胞 1(R1 和 R3)或细胞 2(R2 和 R4)施加从 -80 pA 到 200 pA(步长为 20 pA)的电流注入时,细胞 1 和细胞 2 的电压记录轨迹。
录像6 机器人化双电极膜片钳操作过程
录像7 双电极全细胞记录
6.机器人化脑片和活体膜片钳操作系统的应用
1)面向机械应力敏感性离子通道兴奋性研究的机器人话双臂膜片钳系统
课题组提出了一种具有定量施加机械刺激功能的快速的机器人化的双臂膜片钳系统,用于研究脑片中神经元的机械应力敏感性兴奋性,如图18所示。首先,使用了一个结合蒙特卡洛方法的双臂膜片钳系统运动学模型,用于计算记录微电极和刺激微电极的工作空间,并优化末端执行器的长度,以减少操作期间的碰撞发生率。然后,基于压入深度控制,提出了一种利用单个微电极对细胞进行定量应力刺激的方法。最后,提出了一种基于双微电极三阶段运动控制的快速机器人化双臂膜片钳操作流程,用于接近目标细胞并形成施加定量机械应力刺激的全细胞记录,如图19,录像6和7所示。基于上述方法,课题组在小鼠脑片初级视皮层的50个锥体神经元上进行实验。结果表明,与手动操作相比,该系统的操作效率提高了三倍,接触过程的成功率提高了37%,全细胞记录的成功率提高了42%。利用这些优势,实验观察到在初级视皮层中机械刺激调节了神经元兴奋性的增强,如图20所示。实验结果还表明,钠离子电流可能比钾离子电流对机械应力刺激更敏感。系统显著提高了脑片中神经元机械刺激诱导兴奋性的研究效率,因此该方法在未来有可能用于研究机械应力敏感性离子通道功能障碍导致的致疾病的病理机制和致病机制。上述工作已经正式发表在IEEE Transactions on Biomedical Engineering 杂志上(Biting Ma, Qili Zhao*. IEEE TBME. 72(2), 2024)。

图21 机器人化双臂膜片钳系统

图22 双臂膜片钳操作流程
录像8 双电极自动接近目标细胞过程录像
录像9 细胞定量刺激与兴奋性检测录像

图23 细胞机械应力敏感兴奋性实验结果。
2)面向在体环境动态成像方法机器人荧光照明方法
为了实现“显示清”在体的盲环境,本项目提出了一种基于动态荧光成像建模的机器人荧光照明方法。目前,操作人员通常会小心地吹满荧光染料溶液的微管,在微管开口周围形成荧光场,照亮体内环境。这种对荧光场的手动动态控制通常是一种低精度、劳动密集型和高技能要求的任务,当微管移动以定位或接近目标细胞时,变得更具挑战性。大量的体内光照控制试验可以提高荧光领域的人工控制效率,但它们通常需要许多精确的动物样本,使其成本高昂,往往难以承受。为了提高荧光场的动态控制效率,同时降低实验成本,提出了一种基于活体动态荧光成像模拟器的机器人荧光照明控制方法。首先,建立由注射模型、扩散模型和荧光分子发光模型组成的动态荧光成像模型,模拟活体荧光场,如图21所示。通过模型得到的荧光强度分布与实验结果吻合度较高,如图22所示。基于该模型,采用自适应滑模控制器在体内环境中实现所需的荧光强度。仿真结果和实验结果均表明,与手动操作和传统PID控制器相比,该控制器在控制精度和稳态误差方面具有显著的优势,如图23和录像8所示。上述工作已经被IEEE Transactions on Automation Science and Engineering条件接收(Ruimin Li, Zhao Qili*, IEEE TASE, 22: 13716-13727, 2025)。


图24 在体荧光成像模型


图25 实验和模拟的荧光图像。(a)我们定制的双光子显微镜OX坐标系下的荧光场分布。(b)共聚焦显微镜下的荧光场分布。(c)双光子图像模拟的荧光场分布。(d)共聚焦图像模拟的荧光场分布。

图26 脑片实验动态成像实验结果
录像10 在体动态成像控制效果录像
3)面向活体显微操作的微移液管流速精准控制
微量移液器出口流量的精准调控,开发了一套具备 1 帕级控制分辨率的闭环压力调控系统,如图27所示,并基于液滴法(如图28所示)建立了压力 - 流量关系的定量校准方法。校准结果显示,压力与流量呈线性关系,平均压力 - 流量增益为 4.846×10^(-17) 立方米・秒 ^(-1)・帕 ^(-1)(R²>0.99)。验证实验表明,该系统实现了目标出口流量的精准控制,流量控制误差小于 10 飞升 / 秒。最终,脑片环境中的应用结果证实,该系统能够维持稳定的荧光成像,荧光强度波动仅约 1.3%。上述工作已经被Sensors接收(Ruimin Li, Shaojie Fu, Xin Zhao*, Sensors 2025, 25, 6647)。
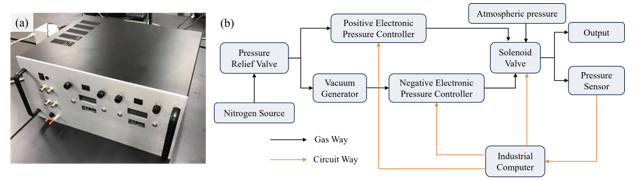
图27 闭环气压调节系统。(a)系统实物图。(b)气压闭环控制框图。
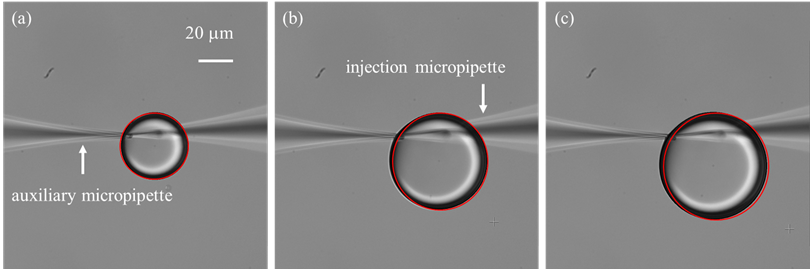
图28 在 60 百帕注射压力下,液滴生长的延时成像以 20 帧为间隔记录。红色轮廓代表通过霍夫圆检测变换识别出的液滴边界。(a)初始帧;(b)第 20 帧图像;(c)第 40 帧图像。
4)机器人化活体盲法膜片钳操作
课题组在传统的脑片膜片钳系统上,加装自主设计的活体动物固定装置,通过活体小鼠头部开颅和颅骨粘连手术,将小鼠头部固定到膜片钳操作平台上,如图29所示。进一步地,基于图像拼接对骨缝进行定位,进而确定各个脑区的三维位置,规划操作微针的三维运动轨迹,并通过检测电阻值实现进入大脑环境、接触细胞、高阻封接和破膜的自动判断,最终获得了活体小鼠大脑神经元的动作电位,如图30所示。

图29 活体小鼠膜片钳实验图片

图30 活体小鼠神经元动作电位

